本文來源:時代商學院 作者:黃祐芊
來源 | 時代商學院
作者 | 黃祐芊
編輯 | 陳鑫鑫
【摘要】
1. 廣東醫療器械企業數量遙領全國。據統計,截至2021年12月31日,全國共有Ⅱ、Ⅲ類醫療器械經營企業92.55萬家,同比增長17.4%。其中,廣東醫療器械經營企業數量最多,遠超其他省份。上市公司方面,2021年,A+H股合計新增37家醫療器械上市公司,比2020年新增的21家增長76.2%。
2. 超億元融資數量同比增長39%。2021年,我療器械行業共發生386起融資,較2020年的360起同比增長7.22%。按融資規模看,2021年,我國醫療器械領域的融資金額約為502.9億元,同比減少3.42%。按融資企業細分領域看,2020年,體外診斷(IVD)融資數量為121起,遠超醫療器械其他細分領域,成為年度之最;2021年,該領域仍為最大熱門,以120起融資再登榜首。融資規模方面,2021年,IVD行業以138.55億元的融資規模再度穩居首位。
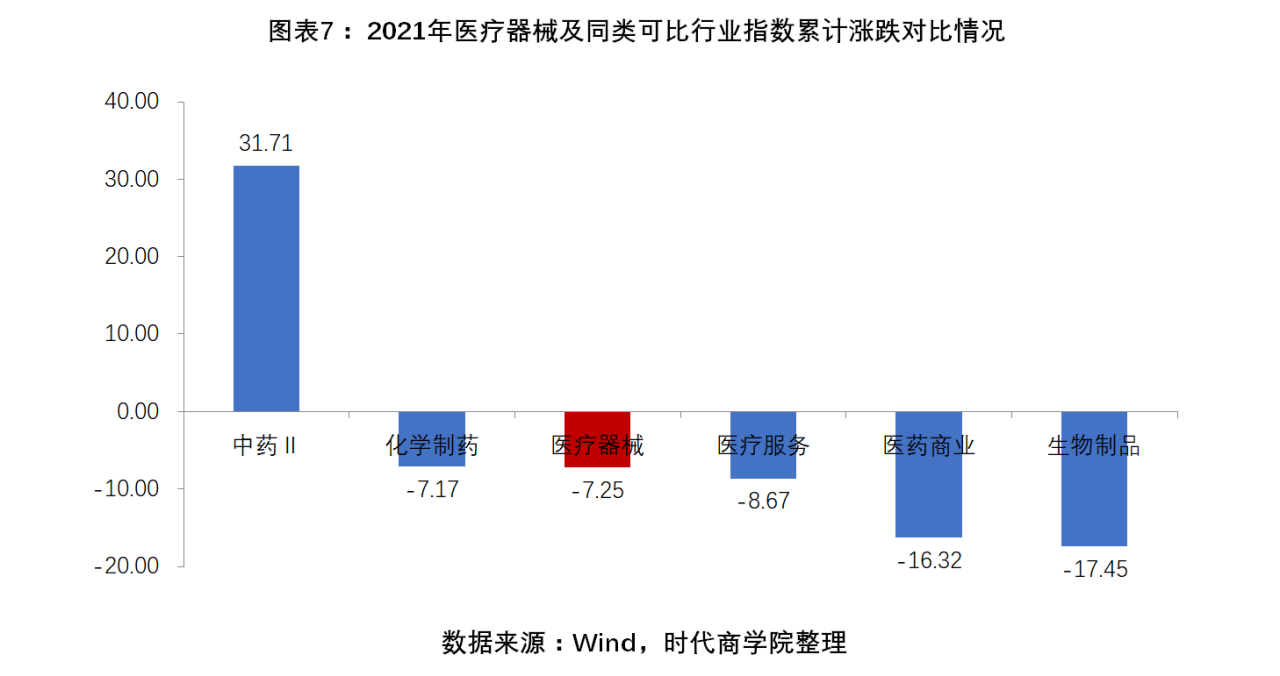
3. 醫療器械指數全年累計下滑7.25%。2021年,醫療器械指數以7.25%的累計跌幅排名第九十九,跑輸上證指數12.05個百分點、深證成指9.92個百分點、滬深300指數2.05個百分點。對比一級行業醫藥生物細分的其它行業,其中中藥、化學制藥、醫療服務、醫藥商業、生物制品,2021年累計漲跌幅分別為31.71%、-7.17%、-8.67%、-16.32%、-17.45%,醫療器械-7.25%的跌幅排名第三。
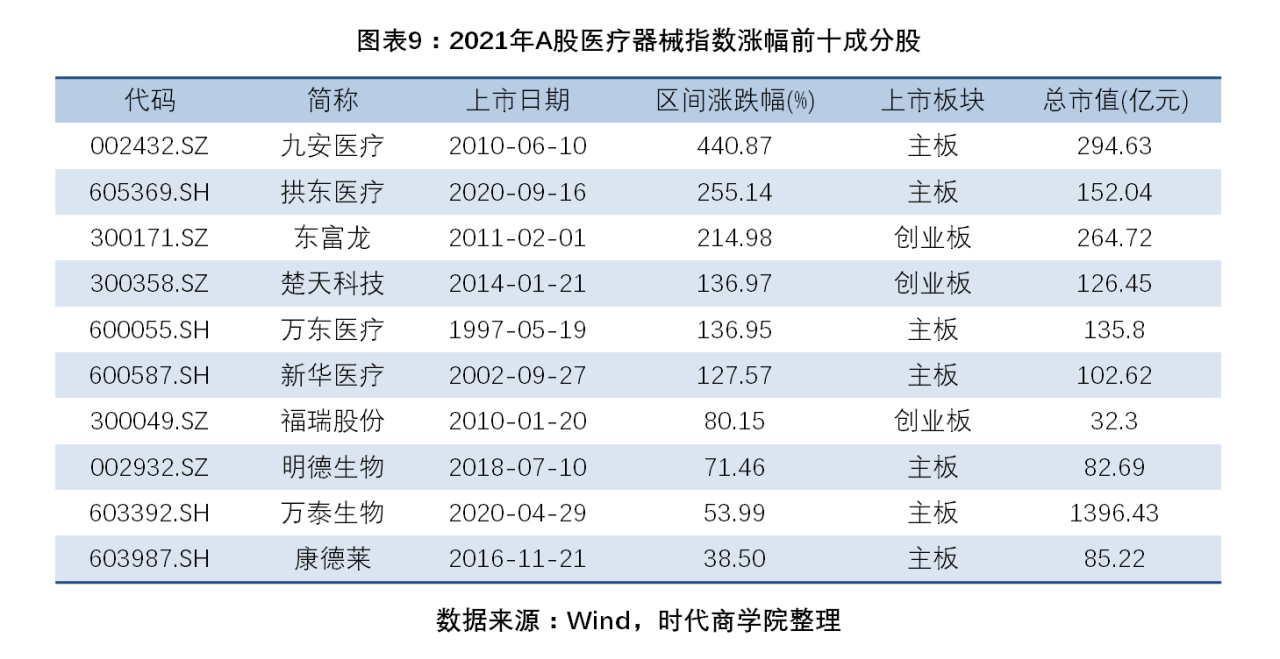
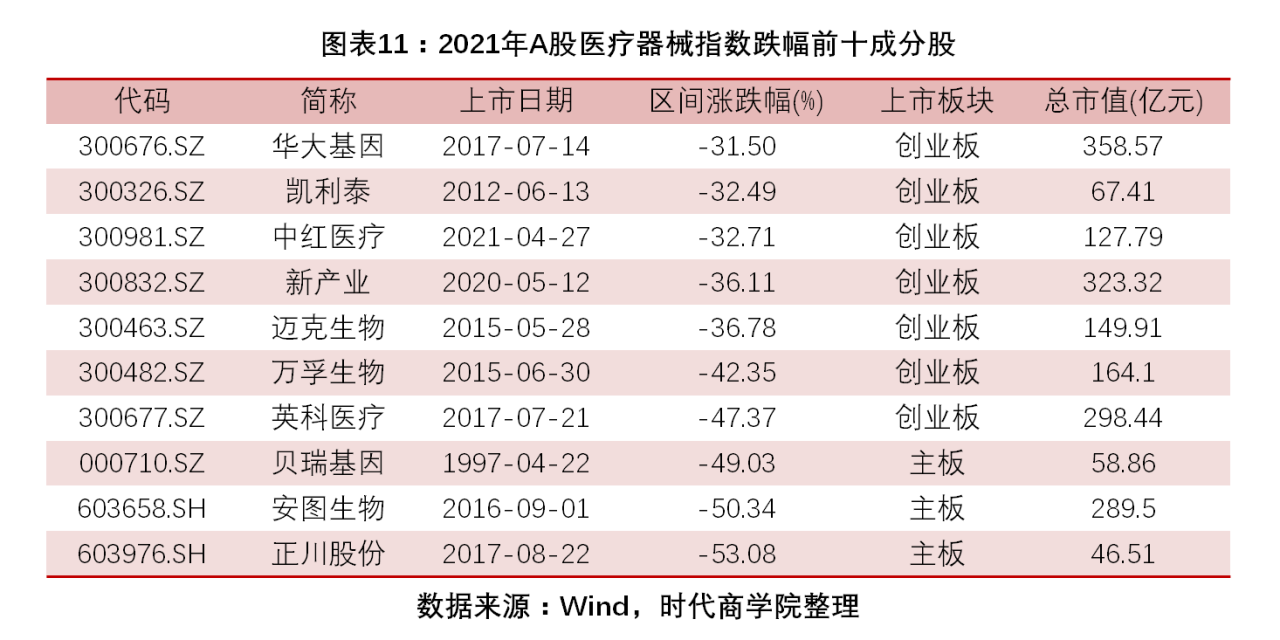
4. 6只成分股翻倍增長,3只成分股由漲幅前十下滑至跌幅前十。2021年,醫療器械指數64只成分股中,有20只股價累計上漲。其中,漲幅最大,達440.87%。、、在2020年累計漲幅超100%,位居醫療器械指數漲跌幅前十,到了2021年,上述企業分別以-47.37%、-53.08%、-36.11%的跌幅成為該年度跌幅前十成分股。
目錄
一、行業基本情況
廣東醫療器械經營企業遙領全國
超億元融資數量同比增長39%
體外診斷融資數量及規模蟬聯榜首
二、市場表現
醫療器械指數全年累計下滑7.25%
6只成分股翻倍增長,九安醫療漲幅超440%
3只成分股由漲幅前十下滑至跌幅前十,正川股份被實名舉報
三、行業十大要聞
四、券商研報觀察
五、政策春風不斷,國內醫療器械行業迎來風口
圖表目錄
圖表 1:2021年全國醫療器械經營企業數量Top10省份
圖表 2:2020—2021年A+H股各板塊新上市公司占比情況
圖表 3:2020—2021年醫療器械融資數量(單位:起)
圖表 4:2020—2021年醫療器械融資規模(單位:億元)
圖表 5:2020—2021年醫療器械細分領域融資情況(單位:起)
圖表 6:2020—2021年醫療器械細分領域融資規模(單位:億元)
圖表 7:2021年醫療器械及同類可比行業指數累計漲跌對比情況
圖表 8:2017—2021年醫療器械及同類可比行業指數累計漲跌對比情況(%)
圖表 9:2021年A股醫療器械指數漲幅前十成分股
圖表 10:2020年1月至2021年12月九安醫療股價走勢
圖表 11:2021年A股醫療器械指數跌幅前十成分股
圖表 12:2020年1月至2021年12月正川股份股價走勢
一、行業基本情況
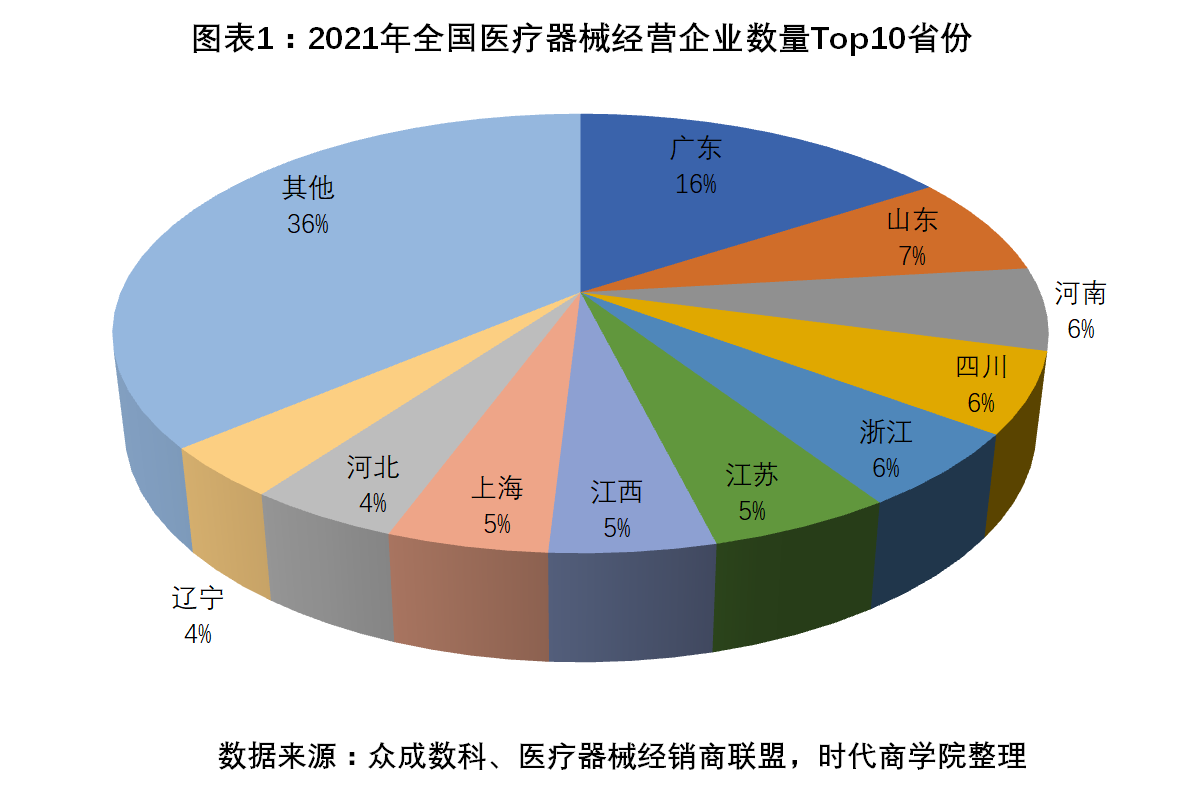
廣東醫療器械企業數量遙領全國
據眾成數科統計,截至2021年12月31日,全國共有Ⅱ、Ⅲ類醫療器械經營企業92.55萬家,同比增長17.4%。其中,同時經營Ⅱ、Ⅲ類醫療器械產品的企業合計17.53萬家,僅經營Ⅱ類醫療器械產品的企業68.23萬家,僅經營Ⅲ類醫療器械產品的企業6.79萬家。
按地域劃分,廣東省醫療器械經營企業數量最多,達14.61萬家,遙遙領先其他省份;山東省以6.82萬家的醫療器械經營企業位居第二;河南省排名第三,合計有5.63萬家醫療器械經營企業。
此外,四川省、浙江省、江蘇省、江西省、上海、河北省、遼寧省分別以5.48萬家、5.18萬家、4.95萬家、4.45萬家、4.33萬家、4.09萬家、3.5萬家的醫療器械經營企業排名前十。
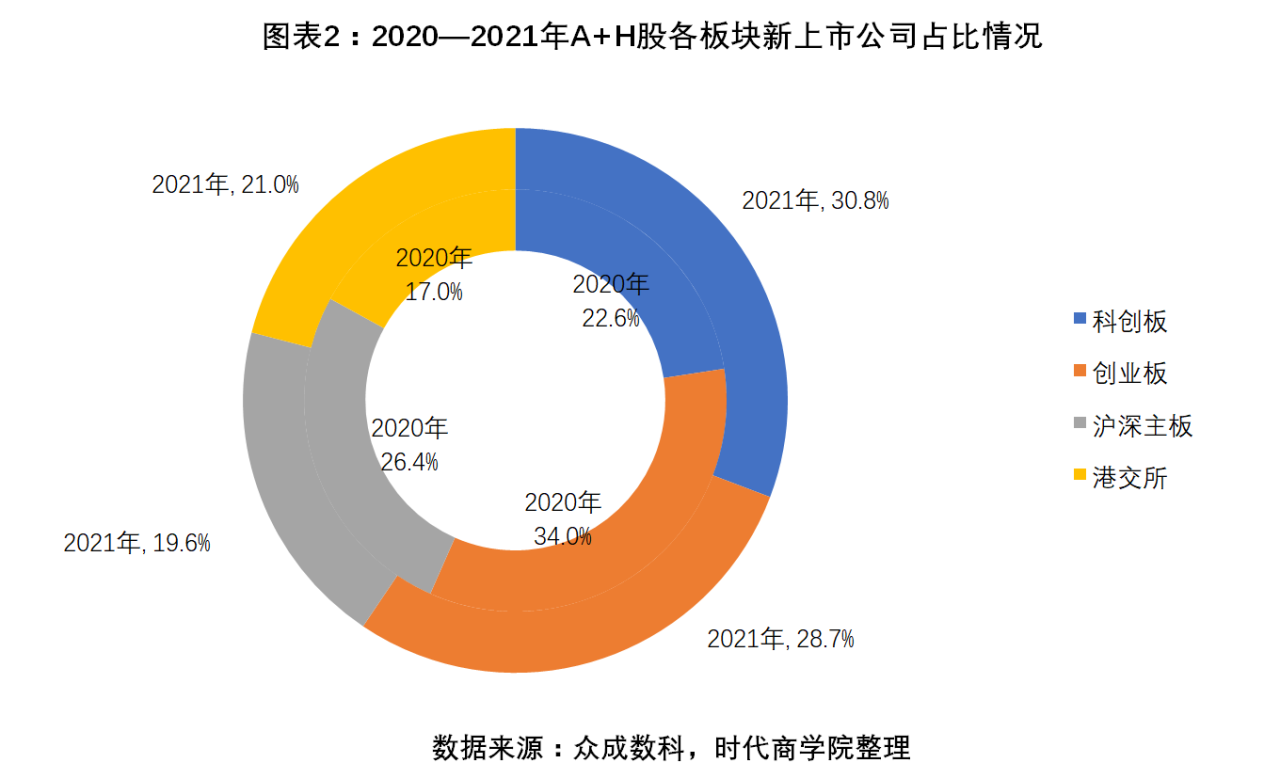
上市公司方面,2021年,A+H股合計新增37家醫療器械上市公司,比2020年新增的21家增長76.2%。37家新上市醫療器械企業合計募資596億元,比2020年的288億元同比增長106.94%。
37家新上市醫療器械企業中,有30.8%的企業在科創板上市,同比上升約8.2個百分點;創業板、主板分別占比28.7%、19.6%,分別同比下滑約5.3個百分點、6.8個百分點;港交所新上市的醫療器械企業占比21%,同比上漲4個百分點。
超億元融資數量同比增長39%
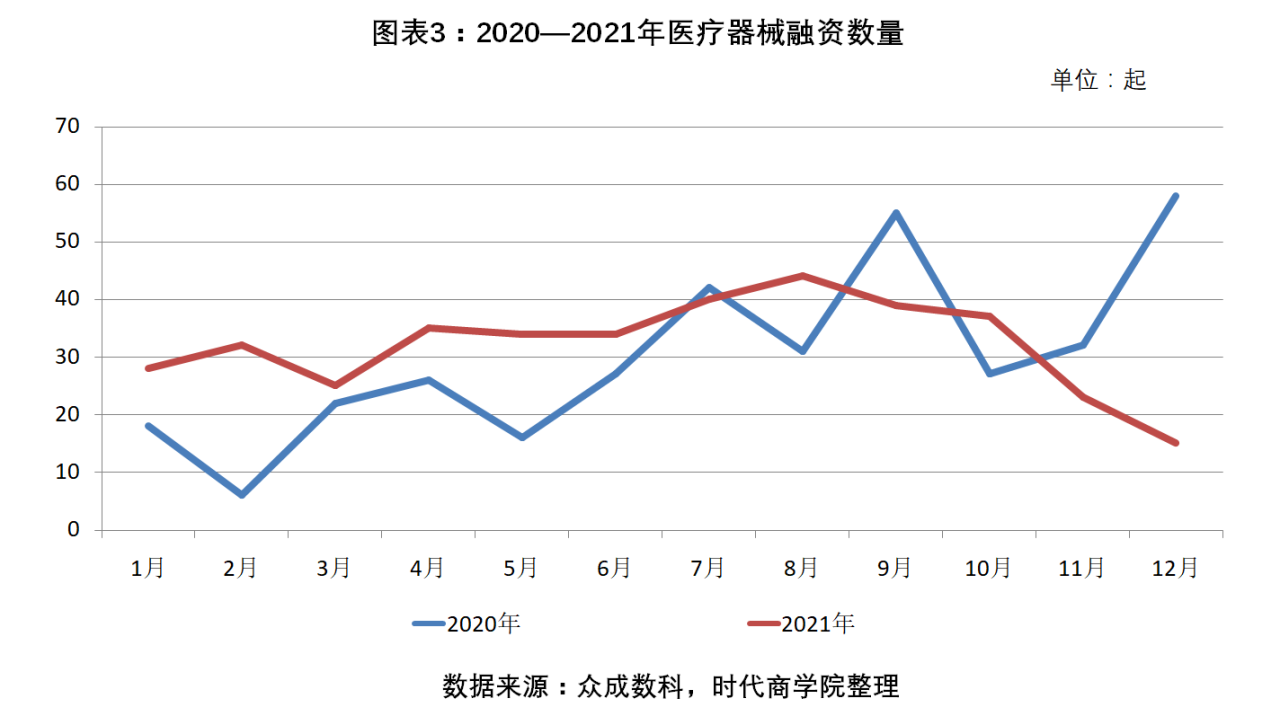
融資方面,2021年,我國醫療器械行業共發生386起融資,較2020年的360起同比增長7.22%。其中,二季度、三季度融資數量較多,8月融資數量抵達峰值,合計44起;四季度融資項目數量直線下滑,12月融資數量僅為15起。
對比2020年醫療器械融資項目數量,2021年上半年融資數量超去年同期,而8月份之后融資數量開始下降,整體低于去年同期。12月份的融資數量差距最大,2020年當月的融資數量達58起,為全年峰值,約為2021年同期融資數量的4倍。
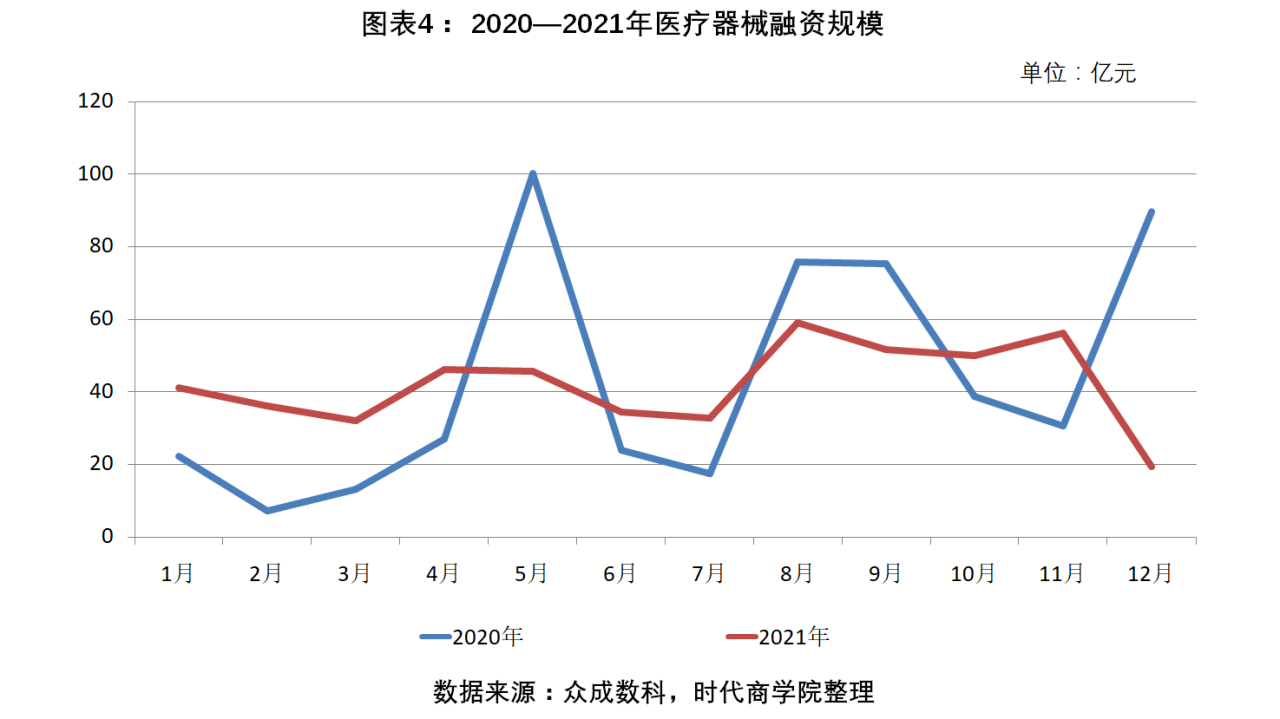
按融資規模看,2021年,我國醫療器械領域的融資金額約為502.9億元,同比減少3.42%。具體到月份,2021年1—4月、7月、10—11月的融資金額皆高于上年度同期的融資金額。
其中,8月融資金額達58.9億元,為全年峰值;11月以56億元的融資金額位列第二;9月、10月的融資金額在50億元上下波動,分別為51.5億元、49.9億元,排名第三、第四;12月的融資金額全年最低,僅為19.2億元,約為上年度同期的1/5。由于2020年5月、8月、9月、12月的融資金額較大,與2021年同期差距較大,導致2021年整體融資規模不及2020年。
據統計,2021年,合計發生217起超億元級融資事件,比2020年的156起增長39.1%;2020年、2021年,超十億元級的融資事件分別為11起、3起,2021年超大額融資數量顯著下滑。
體外診斷融資數量及規模蟬聯榜首
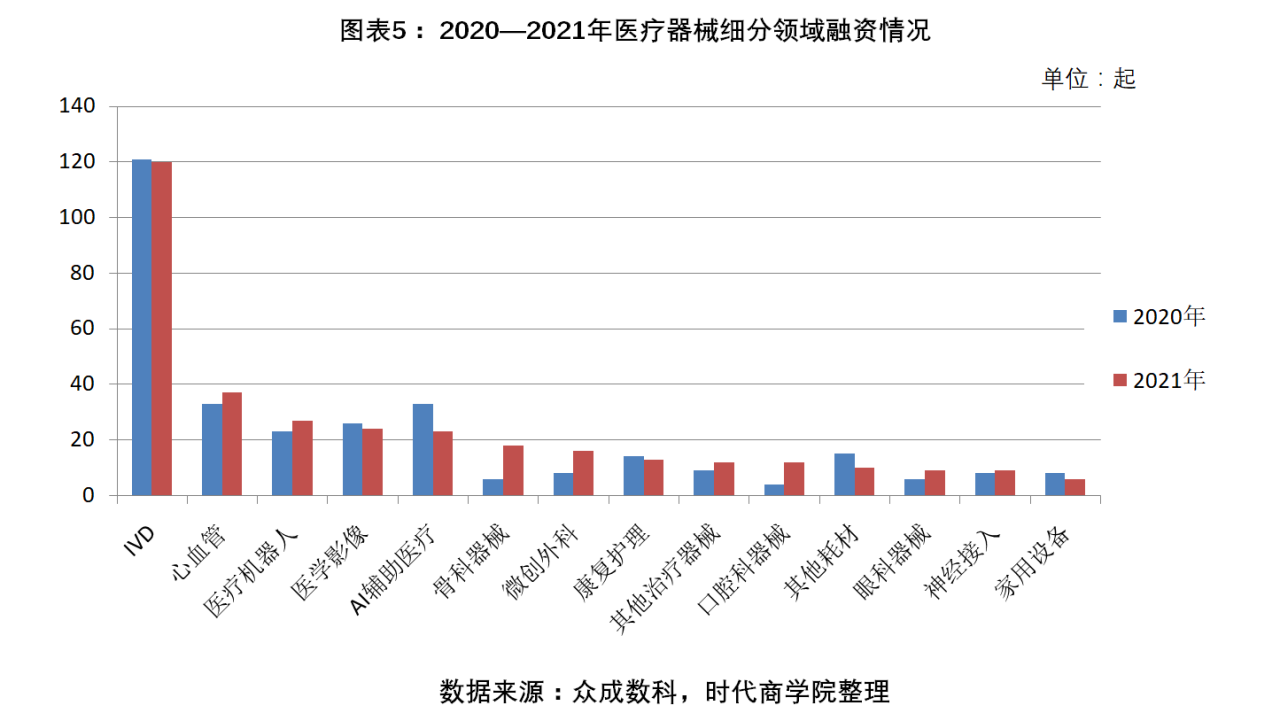
按融資企業細分領域看,2020年,體外診斷(IVD)融資數量為121起,遠超醫療器械其他細分領域,成為年度之最;2021年,該領域仍為最大熱門,以120起融資再登榜首。心血管、AI輔助醫療領域各以33起融資數量位列2020年第二大熱門,到2021年,心血管以37起融資數量蟬聯榜眼,AI輔助醫療則下滑3位,以23起融資數量排名第五。
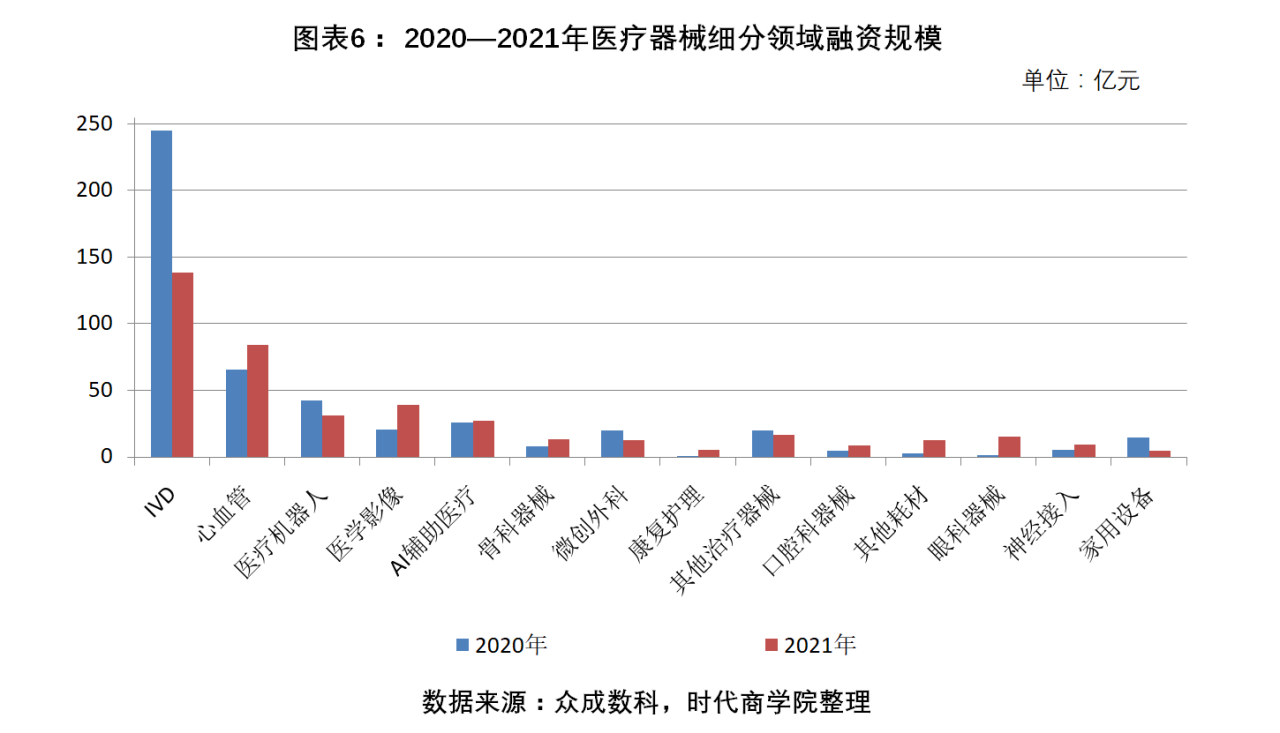
2021年,IVD行業以138.55億元的融資規模穩居首位,但與2020的245.21億元相比,整體規模明顯下降,跌幅達43.5%。心血管、醫學影像、眼科器械等細分領域的融資金額比上年度增加較多,同比增幅分別為28.18%、86.19%、1065.91%。可見,投資者對上述領域的發展前景認可度較高。
二、市場表現
醫療器械指數全年累計下滑7.25%
市場表現方面,2021年全年,上證指數(000001.SH)累計上漲4.8%,深證成指(399001.SZ)累計上漲2.67%,滬深300指數(000300.SH)累計下跌5.2%。
按申萬二級分類,非金屬材料(801039.SI)、電機(801731.SI)、小金屬(801054.SI)、能源金屬(801056.SI)、其他電源設備(801733.SI)行業指數累計漲幅排名前五,分別為138.11%、83.41%、69.3%、68.57%、66.26%。
醫療器械指數(801153.SI)以7.25%的累計跌幅排名第九十九,跑輸上證指數12.05個百分點、深證成指9.92個百分點、滬深300指數2.05個百分點。
對比一級行業醫藥生物細分的其它行業,其中中藥(801155.SI)、化學制藥(801151.SI)、醫療服務(801156.SI)、醫藥商業(801154.SI)、生物制品(801152.SI),2021年累計漲跌幅分別為31.71%、-7.17%、-8.67%、-16.32%、-17.45%,醫療器械-7.25%的跌幅排名第三。
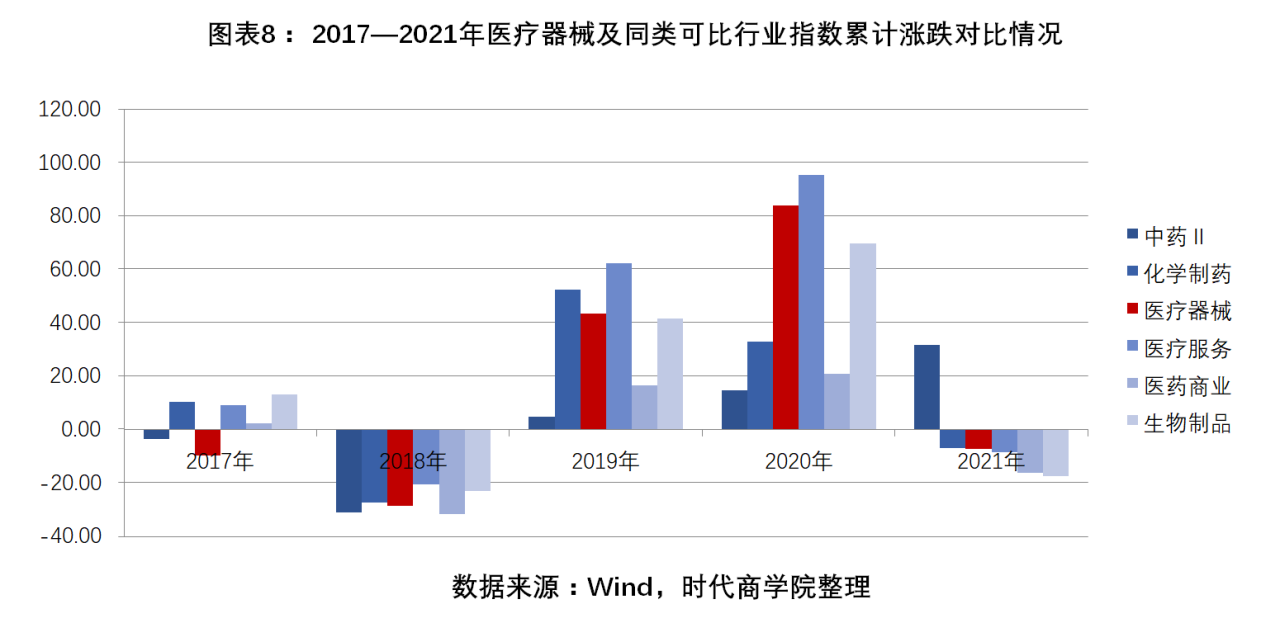
近五年來,醫療器械指數走勢分別為-9.72%、-28.6%、43.38%、83.82%、-7.25%。2017年,醫療器械指數漲跌幅與中藥、化學制藥、醫療服務、醫藥商業、生物制品等指數相比,排名倒數第一;2018—2021年,醫療器械指數漲跌幅排名分別為第四、第三、第二、第三。
6只成分股翻倍增長,九安醫療漲幅超440%
具體而言,2021年,醫療器械指數64只成分股中,有20只股價累計上漲。其中,九安醫療(002432.SZ)漲幅最大,達440.87%。此外,漲幅超100%的企業還有(605369.SH)、(300171.SZ)、(300358.SZ)、(600055.SH)、(600587.SH),上述5家企業的漲幅分別為255.14%、214.98%、136.97%、136.95%、127.57%。
(300049.SZ)、(002932.SZ)、(603392.SH)、(603987.SH)分別以80.15%、71.46%、53.99%、38.5%的漲幅擠進前十榜單。
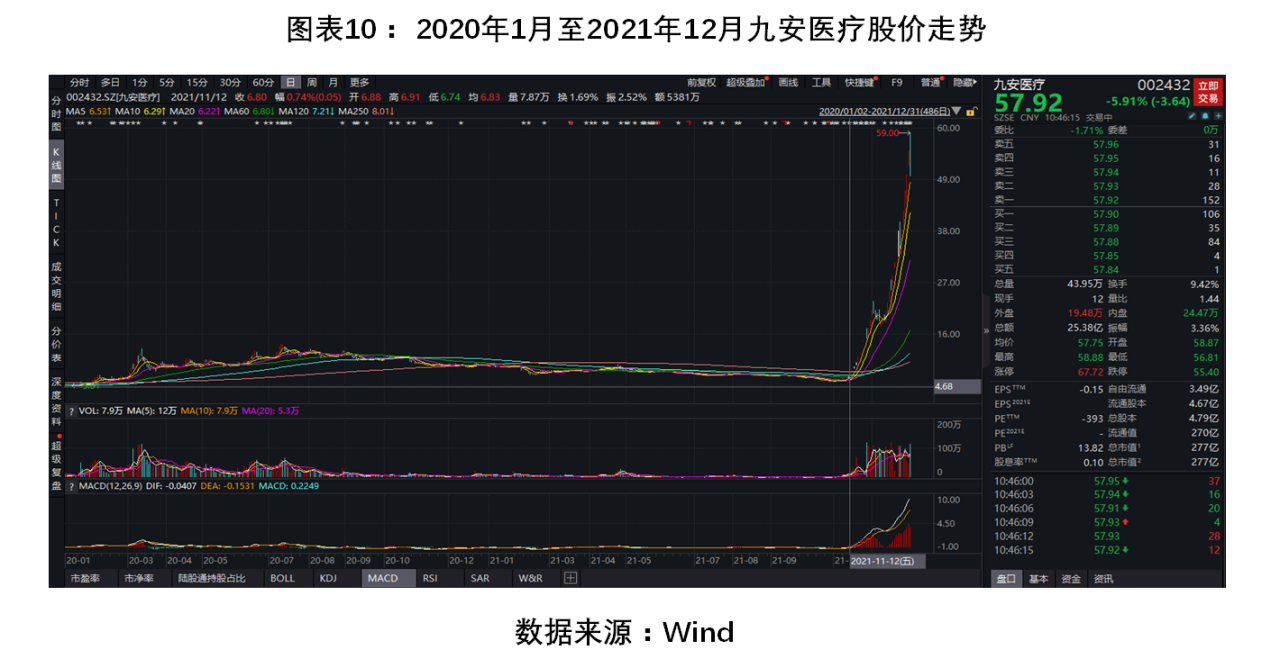
值得一提的是,2020年1月至2021年11月,九安醫療的股價趨向平緩,自2021年11月8日,該公司發布了一則公告稱,子公司iHealth的新型冠狀病毒(SARS-CoV-2)抗原家用自測OTC試劑盒已獲得美國食品藥品監督管理局(FDA)應急使用(EUA)授權,可在美國公共衛生健康應急期間,在美國和認可美國EAU的國家/地區銷售。
隨后,九安醫療在互動易平臺上回應投資者稱,該試劑盒產品在Amazon美國網站銷售排名第一。目前,該產品月產能為1億人份,計劃到2022年初,產能增至每月2億人份。受此“激勵”,九安醫療的股價便扶搖直上,陸續收獲25次漲停。
期間,深交所先后4次向九安醫療出具監管函及關注函,側重點主要在問詢九安醫療是否存在利用公開平臺迎合市場熱點、炒作公司股價的情形。不過,市場并未受到影響,2021年11月8日至2022年2月9日,該公司股價累計漲幅達882.5%。
3只成分股由漲幅前十下滑至跌幅前十,正川股份被實名舉報
需要關注的是,英科醫療(300677.SZ)、正川股份(603976.SH)、新產業(300832.SZ)在2020年累計漲幅超100%,位居醫療器械指數漲跌幅前十,英科醫療更是以1428.06%的漲幅排名第二。到了2021年,上述企業分別以-47.37%、-53.08%、-36.11%的跌幅成為該年度跌幅前十成分股。
正川股份主要從事藥用玻璃包裝,2019—2020年,該公司營業收入分別為5.21億元、5.02億元,分別同比下滑12.54%、3.67%;歸屬于上市公司股東的扣非凈利潤分別為5821.7萬元、4714.08萬元,分別同比下滑28.9%、19.03%。與同行可比上市公司對比,正川股份凈資產、凈利潤、毛利率、凈利潤、ROE等指標,均不及行業平均值。
醫藥包裝領域,藥用玻璃屬于應用較早、發展較成熟的細分行業之一,行業競爭者眾多,大型企業與中小型企業并存,經營分散,競爭激烈。正川股份業績持續下滑,與競爭對手差距不斷擴大,不利于該公司持續發展。
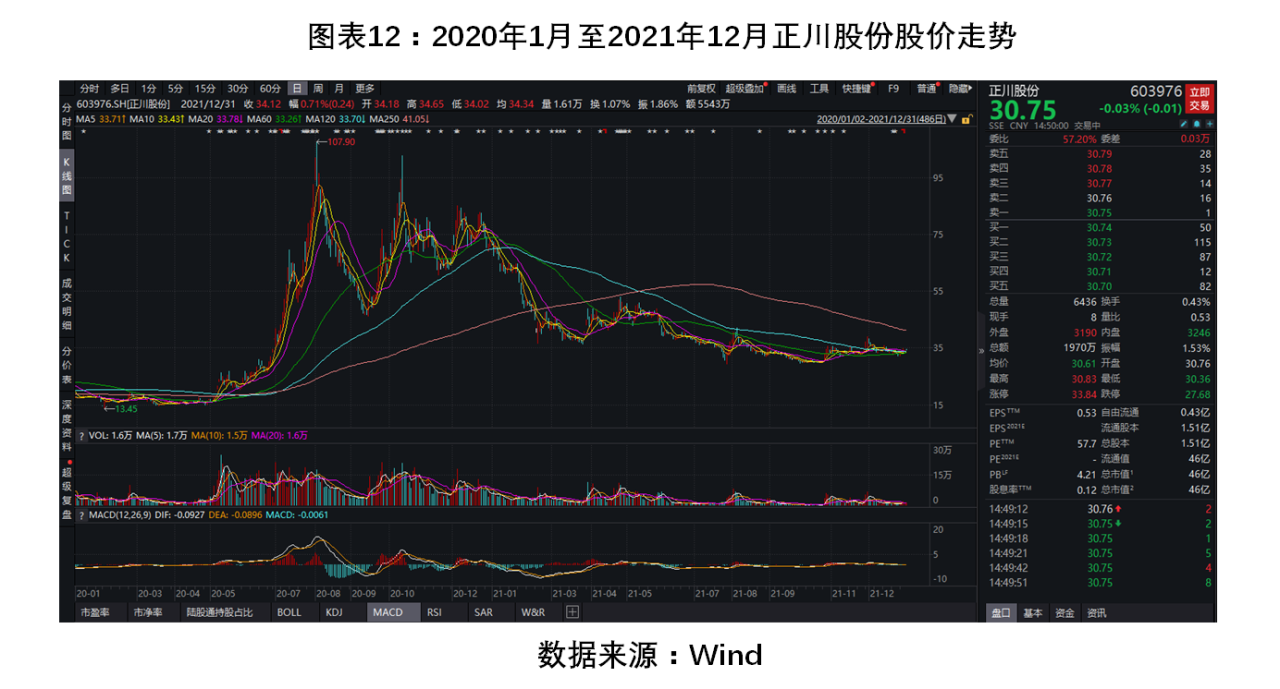
從圖表7可看到,2020年5月伊始,新冠疫苗瓶短缺的消息備受關注,正川股份由此受到資本市場青睞,股價從5月7日的16.09元/股開始快速飛升。隨后,該公司發布公告稱,擬發行可轉債共計4.05億元,用于中硼硅藥用玻璃生產項目和研究項目。公告一出,正川股份便迎來連續3個交易日漲停,于8月4日抵達峰值107.96元/股,3個月內漲幅高達571%。
在此期間,正川股份股東、高管逢高減持,實控人鄧勇的一致行動人鄧紅、鄧步莉被指“清倉式”減持;此外,鄧勇家族合計減持1.9%的股份,套現1.71億元。隨后,上交所對正川股份及相關責任人應披露而未披露重大信息,可能導致股價異常波動,作出通報批評。
2021年5月,重慶必揚律師事務所主任余澤東實名舉報正川股份實控人鄧勇利用市場熱點,大肆炒作疫苗玻璃瓶概念操縱、哄抬股價,在拉高股價后,鄧勇家族成員開始高位減持股票套現。證監會已接受余澤東的舉報材料,目前尚未有最終審查結果。或許是受此影響,正川股份此后的股價呈波動性下滑,截至年底未見有大幅抬升。
三、行業十大要聞
1. 【首批15家醫療器械唯一標識實施示范單位公布】
1月26日,《國家藥監局綜合司關于進一步做好醫療器械唯一標識示范推廣工作的通知》(以下簡稱《通知》)發布,公布了首批15家醫療器械唯一標識實施示范單位。
這15家示范單位分別為:北京愛康宜誠醫療器材有限公司、上海微創醫療器械(集團)有限公司、深圳邁瑞生物醫療電子股份有限公司、威高集團有限公司、科技股份有限公司、波科國際貿易(上海)有限公司、股份有限公司、中國醫療器械有限公司、華潤廣東醫藥有限公司、北京世紀壇醫院、中山大學附屬第一醫院、上海市第一人民醫院、北京大學第三醫院、鄭州大學第一附屬醫院、泉州市正骨醫院。
《通知》顯示,自2021年1月1日首批醫療器械唯一標識實施工作開展以來,唯一標識在醫療器械生產、流通、使用全鏈條各環節成功得到示范應用,有力助推了醫療器械從源頭生產到臨床使用全鏈條聯動。為進一步做好唯一標識示范推廣,國家藥監局組織醫藥、衛生、醫保領域專家開展了唯一標識實施示范單位遴選工作,遴選出首批15家醫療器械唯一標識實施示范單位。
《通知》要求,各示范單位要進一步拓展唯一標識實施應用,主動與上下游開展銜接,強化唯一標識全鏈條聯動;進一步總結經驗,形成長效機制,不斷提升工作水平,切實發揮引領示范作用;固定專人負責,按照培訓需求合理制定培訓計劃,認真組織開展唯一標識宣貫培訓和觀摩學習,鼓勵示范單位間開展合作交流,進一步提升示范應用效果,每半年總結示范應用工作情況報送國家藥監局。(報)
2. 【2022年全國醫療器械監督管理工作會議在京召開】
1月27日,2022年全國醫療器械監督管理工作會議在京召開。會議總結2021年工作,分析當前形勢,部署2022年重點工作。國家藥品監督管理局黨組成員、副局長徐景和出席會議并講話。
徐景和對醫療器械監管工作提出五點要求:深入開展風險隱患排查整治,全力防控質量安全風險;持續加強防疫用械監管,全力服務疫情防控大局;持續深化審評審批制度改革,全力助推產業高質量發展;全面推進風險管理責任落地,落實注冊人備案人、地方政府、監管部門三方責任;全力以赴加強建設,切實提高監管能力和水平。
會議部署了2022年醫療器械注冊管理重點工作:一是縱深推進醫療器械審評審批制度改革。全面落實注冊人制度,全面實施審評審批電子化。二是持續強化醫療器械注冊基礎能力建設。繼續實施標準提高計劃,持續完善醫療器械標準體系,加強分類命名編碼工作。三是全力支持醫療器械產業高質量創新發展。加快創新產品審評審批,促進科技成果轉化應用,支持重點區域產業發展。四是不斷提升醫療器械注冊管理水平。規范地方注冊備案業務,健全審評審批銜接機制,強化臨床試驗機構和試驗項目管理,嚴懲違法行為。(國家藥品監督管理局)
3. 【國家藥監局發布《醫療器械產品技術要求編寫指導原則》】
為提高醫療器械技術審評的規范性和科學性,指導醫療器械注冊人/備案人編寫產品技術要求,國家藥品監督管理局組織修訂了《醫療器械產品技術要求編寫指導原則》,并于2022年2月9日在國家藥監局網站進行發布。
《指導原則》從適用范圍、基本要求、主要內容、性能指標要求、格式要求5方面作出具體說明。《指導原則》還規定,產品技術要求的內容一般包括產品名稱,型號、規格及其劃分說明(必要時),性能指標,檢驗方法,術語(如適用)及附錄(如適用)。
根據《指導原則》,技術要求中的性能指標是指可進行客觀判定的成品的功能性、安全性指標。而可進行客觀判定的指標通常是指可量化或可客觀描述的指標。
《指導原則》通過舉例對性能指標要求作出明確,以血液透析器產品為例,其重要功能是對目標物質的清除,該功能實現的效果可直接通過測量被清除目標物質的剩余量獲得驗證,因此宜在技術要求規定,以表征其主要功能性。
同時,《指導原則》還明確,研究性及評價性內容以及非成品相關內容不建議在技術要求性能指標中體現。(中國食品藥品網)
4. 【京津冀“3+N”聯盟集采工作方案發布骨科創傷類醫用耗材價格或將降到新低】
2022年2月9日,北京市醫藥集中采購服務中心、天津市醫藥采購中心、河北省醫用藥品器械集中采購中心聯合發布了《京津冀“3+N”聯盟骨科創傷類醫用耗材帶量聯動采購和使用工作方案》(以下簡稱《工作方案》)。
按照《工作方案》計劃,此次京津冀“3+N”集采包括天津市、內蒙古自治區、遼寧省、吉林省、黑龍江省、浙江省等19個省級集采單位,涉及普通接骨板系統、鎖定加壓接骨板系統(含萬向)和髓內釘系統三個采購包,包括接骨板及配套螺釘、髓內釘及配件、中空(空心)螺釘等骨科創傷類醫用耗材。
值得注意的是,此次聯盟集采是繼河南等十二省市骨科創傷類醫用耗材聯盟(以下簡稱河南聯盟)集采后又一聯盟將目光瞄準了骨科創傷類醫用耗材集采,所涉及的集采品種也多與河南聯盟重合,骨科創傷類醫用耗材集采幾乎覆蓋全國。
而在此次集采的《工作方案》中也特別強調要聯動河南聯盟帶量采購價格,通過購銷雙方互相選擇,確定中選產品,按照帶量分包,實行帶量聯動采購。此次集采或將骨科創傷類醫用耗材價格降到新低。(中國醫藥報)
5. 【國家藥監局發布《2021年度醫療器械注冊工作報告》】
1月27日,國家藥監局發布的《2021年度醫療器械注冊工作報告》顯示,2021年,國家藥監局批準35個器械上市,比2020年增加35%,應急審批14個新冠病毒檢測試劑。
從2014年至2021年,國家藥監局共批準134個創新醫療器械,其中,境內創新醫療器械涉及14個省的104家企業,進口創新醫療器械涉及2個國家的5個企業。北京、上海、廣東、江蘇、浙江創新醫療器械獲批產品數量和相應企業數量最多,約占全部已批準的134個創新醫療器械的81%。
截至2021年底,國家藥監局共批準新冠病毒檢測試劑68個,包括34個核酸檢測試劑、31個抗體檢測試劑、3個抗原檢測試劑,產能達到5130.6萬人份/天,為常態化疫情防控工作提供了有力保障。
同時,國家藥監局還批準了基因測序儀、核酸檢測儀、呼吸機和血液凈化裝置等16個儀器設備。截至2021年底,共批準108個新冠疫情防控醫療器械產品。
此外,國家藥監局著力夯實醫療器械注冊管理基礎,標準體系持續健全,分類命名工作更加有效,唯一標識工作穩步推進,分中心建設取得實質進展,規范統一技術審查標準。2021年,國家藥監局共批準79項行業標準制修訂計劃項目,審核發布146項行業標準。截至2021年底,我國現行有效醫療器械標準共1849項,其中國家標準235項,行業標準1614項,標準體系覆蓋性、系統性不斷提升。(新京報、中國質量報)
6. 【新版《醫療器械監督管理條例》發布】
2021年3月19日,國家藥監局官網發布最新版《醫療器械監督管理條例》,并明確指出該條例自2021年6月1日起施行。
醫療器械直接關系人民群眾生命健康。近年來,隨著醫療器械產業快速發展,黨中央、國務院對藥品醫療器械審評審批制度改革作出一系列重大決策部署,有必要對原條例進行相應修訂,以法規形式鞏固改革成果,從制度層面進一步促進行業創新,更好滿足人民群眾對高質量醫療器械的期待。
《條例》落實醫療器械注冊人、備案人制度,強化企業主體責任。規定注冊人、備案人應當建立并有效運行質量管理體系,加強產品上市后管理,建立并執行產品追溯和召回制度,對醫療器械研制、生產、經營、使用全過程中的安全性、有效性依法承擔責任。
《條例》落實“放管服”改革舉措,鼓勵行業創新發展。將醫療器械創新納入發展重點,優化審批、備案程序,對臨床試驗實行默示許可,縮短審查期限,實行告知性備案。
《條例》完善監管制度,提高監管效能。加強監管隊伍建設,建立職業化專業化檢查員制度,豐富監管手段,進一步明確部門職責分工,加強對醫療器械使用行為的監督檢查。
《條例》加大懲處力度,提高違法成本。落實“處罰到人”要求,加大對違法單位的行業和市場禁入處罰力度,大幅提高罰款幅度。(新京報)
7. 【八部門發布關于開展高值醫用耗材集中帶量采購和使用的指導意見】
2021年6月4日,國家醫保局、發改委等八部門發布關于開展國家組織高值醫用耗材集中帶量采購和使用的指導意見,完善高值醫用耗材價格形成機制,治理價格虛高問題,進一步明顯降低患者醫藥負擔。
意見指出,重點將部分臨床用量較大、采購金額較高、臨床使用較成熟、市場競爭較充分、同質化水平較高的高值醫用耗材納入采購范圍,并根據市場銷售情況、臨床使用需求以及醫療技術進步等因素,確定入圍標準。
已取得集中帶量采購范圍內產品合法資質的醫療器械注冊人(備案人),在質量標準、生產能力、供應穩定性、企業信用等方面達到集中帶量采購要求的,均可參加。境外醫療器械注冊人(備案人)應當指定我國境內企業法人協助其履行相應的法律義務。
所有公立醫療機構(含軍隊醫療機構)均應按規定參加高值醫用耗材集中帶量采購,醫保定點社會辦醫療機構可按所在省(自治區、直轄市)的相關規定,自愿參加集中帶量采購。
醫療機構應優先采購集中采購中選產品,制定優先使用中選產品的院內診療路徑,并按采購合同完成約定采購量。醫務人員應在合理診療原則下,優先使用中選產品。對不按規定采購和使用中選產品的醫療機構,在公立醫院績效考核、醫保總額指標制定、定點協議管理考核、醫療機構負責人目標責任考核中予以懲戒。(健康時報)
8. 【第三類醫療器械全部納入UDI實施范圍】
2021年9月17日,國家藥監局、國家衛生健康委、國家醫保局聯合發布《關于做好第二批實施醫療器械唯一標識工作的公告》(以下簡稱《公告》)。
《公告》明確,在第一批實施醫療器械唯一標識(UDI)的9大類69個品種基礎上,將其余第三類醫療器械(含體外診斷試劑)納入第二批實施UDI范圍。2022年6月1日起,生產的第二批實施UDI的品種應當具有醫療器械UDI。
《公告》明確,對于UDI賦碼,2022年6月1日起,生產的醫療器械應當具有醫療器械UDI;此前已生產的第二批實施UDI的產品可不具有UDI。在UDI注冊系統中,2022年6月1日起,申請首次注冊、延續注冊或者注冊變更時,注冊申請人/注冊人應當在注冊管理系統中提交其最小銷售單元的產品標識。
需要注意的是,2022年6月1日起生產的醫療器械,在其上市銷售前,注冊人應當按照相關標準或者規范要求將最小銷售單元、更高級別包裝的產品標識和相關數據上傳至醫療器械UDI數據庫,確保數據真實、準確、完整、可追溯。當醫療器械最小銷售單元產品標識相關數據發生變化時,注冊人應當在產品上市銷售前,在醫療器械UDI數據庫中進行變更,實現數據更新。
《公告》明確,支持和鼓勵其他醫療器械品種實施UDI。同時,提出對醫療器械注冊人、醫療器械經營企業、醫療機構、發碼機構的要求,強調省級藥監部門、衛生健康部門、醫保部門要加強指導規范,做好第二批醫療器械UDI實施工作。(中國醫藥報)
9. 【臨床急需醫療器械注冊申報可優先審評】
2021年10月29日,家藥監局器審中心官網發布關于臨床急需醫療器械注冊申報有關事宜的通告(2020年第22號)。
為貫徹落實中共中央辦公廳、國務院辦公廳《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(廳字〔2017〕42號),加快臨床急需醫療器械的審評審批,現將用于治療嚴重危及生命且尚無有效治療手段疾病的醫療器械注冊申報有關事宜通告如下。
本通告中所述用于治療嚴重危及生命且尚無有效治療手段疾病的醫療器械,屬于《醫療器械優先審批程序》中第二條第(一)項中5所述“臨床急需,且在我國尚無同品種產品獲準注冊的醫療器械”的一種特殊情形。對于用于治療嚴重危及生命且尚無有效治療手段疾病的醫療器械,醫療器械技術審評中心進行優先審評,符合《醫療器械附條件批準上市指導原則》要求時,可附帶條件批準上市。(國家藥監局)
10. 【“十四五”醫療裝備產業發展規劃出臺,利于醫療器械行業發展】
2021年12月28日,工信部等10部門聯合印發《“十四五”醫療裝備產業發展規劃》。《規劃》聚焦人民日益增長的醫療衛生健康需求,聚焦臨床需求和健康保障,提出了“7556”的推進思路,即圍繞圍繞7個重點領域、部署5項重點任務、實施5個專項行動、采取6項保障措施,推進醫療裝備產業發展目標的實現。
7個重點領域包括診斷檢驗裝備、治療裝備、監護與生命支持裝、中醫診療裝備、婦幼健康裝備、保健康復裝備、有源植介入器械,基本覆蓋了全人群從防、診、治到康、護、養全方位全生命周期醫療健康服務裝備需求。
5項重點任務:一是推進跨界交融,提升技術創新能力。二是強化醫工協同,提升有效供給能力。三是加強品牌建設,提升國際競爭能力。四是培育新模式新業態,提升全方位服務能力。五是優化產業,提升基礎支撐能力。
為確保任務推進,針對每個重點任務分別設立1個專項行動,即:產業基礎攻關行動、重點醫療裝備供給能力提升行動、高端醫療裝備應用示范基地建設行動、緊急醫學救援能力提升行動、醫療裝備產業與應用標準體系完善行動。
6項保障措施:包括創新支持模式、促進推廣應用、加強人才培育、強化知識產權保護、深化開放合作、加強組織協同。(海通國際)
四、券商研報觀察
1. 【康復醫療器械行業專題報告:政策風起,催化需求釋放】
根據《柳葉刀》發表的關于康復的全球疾病負擔研究(GBD),估計全世界約24.1億人可能在患病或受傷期間受益于康復治療。其中,中國的康復需求最大,康復需求人數高達4.6億人。
2021年6月,國家衛健委、發改委等八部委聯合發布《關于印發加快推進康復醫療工作發展意見的通知》,提出要逐步建立一支數量合理、素質優良的康復醫療專業隊伍,力爭到2022年,每10萬人口康復醫師達到6人、康復治療師達到10人。
同年10月,國家衛健委發布《關于開展康復醫療服務試點工作的通知》,2022年將開展15個省份的康復醫療試點工作,積極應對人口老齡化。試點省市先行先試,形成可復制可推廣的地方經驗,以點帶面,帶動全國康復醫療服務快速發展。
根據Frost&Sullivan,2014-2018年,我國康復醫療器械市場規模從115億元增長至280億元,CAGR達到24.9%。預計該市場規模將在2023年增加至670億元,2018—2023年復合增速將為19.1%。我國康復醫療需求廣闊,在政策催化下,國內康復需求有望加速釋放,康復醫療相關機構數量將持續增加,康復醫療器械行業迎來黃金發展期。(東莞證券)
2. 【醫療器械行業深度報告:順勢而為,高質量、創新力、全球化下的新機遇】
醫改深入推進下,國產器械企業在危與機中尋找確定性及高景氣發展機遇隨著新醫改的推進,一些政策如統一耗材編碼、耗材集采、DRG/DIP醫保付費等對醫療器械行業無論是監管還是經營上都產生了深遠影響,并重構了醫療器械廠商產品格局,改變了未來發展策略。
醫療器械企業將在DRG/DIP、集采政策下尋找突圍機會,打開市場空間。(1)DRG/DIP政策對住院期間外的治療并沒有付費限制,醫療器械企業可在術后輔助耗材中尋找機會。(2)創新產品和術式可由當地政府部門進行特別付費申報,創新產品和術式將可為。(3)加快分級診療推進速度,二級醫院檢測市場被打開。(4)DRG/DIP總額付費下,特定術式及部分高值耗材進行集采降價,降價空間有機會留給微創新和檢測方式市場。(5)為滿足付費政策要求,日間手術室將承接部分住院手術。醫院有望開設更多的門診手術間,手術室系統搭建過程中的全套設備將會增配,以及手術必備耗材有望放量。(6)微創化手術縮短住院時間,提高床位周轉率。腔鏡手術的占比將會提高,腔鏡下產品等將會受益。
國產影像設備、高值耗材、體外診斷、介入手術等市場有望迎來放量。(1)DRG/DIP+分級診療政策下檢測設備有望放量,如X射線成像機等;(2)生育政策下婦幼康復檢查市場有望迎來二次繁榮,如康復設備、彩超等;(3)受人口結構老齡化、健康意識提高、醫療品質提升與技術進步等因素影響,體外診斷行業、家用醫療設備呈現出突飛猛進的發展態勢;(4)隨著介入領域疾病檢出和診斷率的提高,臨床相關經驗的不斷提高等,我國介入醫療器械市場規模預計將持續增長,介入醫療企業亦將持續受益于市場擴容。(5)生命科學高分子耗材供應商受益于集采提量及全球化,高分子耗材行業具備優質的ODM商業模式,業績將迎來放量期。(開源證券)
3. 【醫療器械:鑄國之重器,樹中國品牌】
人口老齡化趨勢下,中國創新醫療器械需求總量穩定提升,器械產業發展配套政策趨于完善,醫保局帶量采購政策不斷“進化”。醫療器械產業具有正外部性,“內卷化”是產業創新與配套政策之間沖突的短期現象,長期無需過度悲觀。
海外市場對高性價比醫療器械產品需求凸顯,根據《“十四五”醫療裝備產業發展規劃》,預計到2035年,中國醫療裝備的研發、制造、應用將提升至世界先進水平,進入醫療裝備創新型國家前列。中國將誕生世界級醫械公司。
全球醫療器械領域的底層創新突破加速演進,國產器械持續取得自主創新成績。眾多細分領域手術滲透率遠低于海外,國產替代空間巨大,醫療新基建持續推進。手術、內窺鏡、AED、制藥裝備、醫美、口腔正畸、電生理、神經介入、結構性心臟病、運動醫學、康復器械、連續血糖監測等眾多細分領域有望迎來蓬勃發展。
中國醫療器械產業創新升級,處于優質賽道,擁有持續研發創新、渠道拓展、政府事務、并購整合等多位一體的器械龍頭有望受益。1)平臺型;2)中國制造全球比較優勢;3)處于快速成長階段的創新器械;4)消費型醫療器械。(證券)
4. 【醫藥行業醫療器械板塊2021年三季報總結:高基數下增速放緩,國產替代持續推進】
醫療器械板塊(67家,剔除無同比數據的新股)2021Q1-3收入同比增長21%,歸母凈利潤同比增長22%,扣非歸母凈利潤同比增長26%,業績符合前期預期。
耗材類公司2021Q3增速普遍放緩。由于下半年低基數效應逐漸消除,且個別地區疫情反復,導致手術產業鏈公司Q3表觀收入增速較H1趨于放緩。
醫療設備類持續受益醫藥新基建及國產替代。疫情后時代的“醫療新基建”正如火如荼開展,帶來監護儀、呼吸機、超聲、內窺鏡等醫療設備銷售增量,疊加2020年疫情影響的非疫情類設備采購需求延后至2021年釋放,相關醫療設備公司收入增速有所回升。
部分地區收緊進口醫療設備采購管理,有望加快國產替代進程。安徽已完成部分化學發光類體外診斷試劑的集采,其他地區的體外診斷集采情況需保持跟蹤。
上游制藥裝備領域景氣度較高。受益于新冠疫苗需求的增長,及生物制藥設備國產化進程加速,制藥裝備龍頭三季度仍取得較快增長,如東富龍Q3收入增速為58.83%,楚天科技Q3收入增速為57.90%,且2B類業務不受醫保控費及帶量采購等政策擾動,行業景氣度較高。(國泰君安證券)
5. 【人工關節國采結果落地,國產龍頭有望受益】
2021年9月14日,天津市醫藥采購中心公布國家組織人工關節集中帶量采購擬中選結果。本次共48家企業參與集采,44家中標,中標率92%。擬中選產品預計在2022年3月左右實施。
關節國采結果落地,降幅預計略好于預期,擠出的更多是經銷商的“水分”,國產頭部企業的市場集中度提升與進口替代機會值得期待。
根據之前的人工關節國采方案,此次集采對初次置換人工全髖關節、初次置換人工全膝關節各分為A、B兩組進行競價。根據券商中國的公開數據,擬中選髖關節平均價格從3.5萬元下降至7000元左右,膝關節平均價格從3.2萬元下降至5000元左右,平均降幅約82%。
A組包括了醫療機構累計意向采購量的85%,從該組擬中標情況看,國產頭部企業基本全線中標,剩余量由醫療結構自主選擇,市場集中度有望進一步提升。根據此前的人工關節國采方案,剩余量由醫療機構自主選擇,我們認為無論從質量、安全性還是醫生使用習慣上來講,醫療機構都更傾向于選擇大品牌,小企業僅憑低價較難獲取,預計人工關節市場的集中度有望得到進一步提升。
國產品牌有望憑借性價比優勢持續進行進口替代,擴大份額。通過首年意向采購量計算了3類髖關節以及膝關節的擬中標結果中,進口品牌的份額,在陶瓷-陶瓷、陶瓷-聚乙烯、合金-聚乙烯3類髖關節以及膝關節中,進口品牌份額分別為49%、51%、33%、61%,仍有較大的進口替代空間,國產品牌有望憑借質量、價格及成本等優勢持續替代進口進一步擴大市場份額。()
五、政策春風不斷,國內醫療器械行業快穩發展
2021年,國內醫療器械行業的新規及管理辦法層出不窮,在政策的支持下,該領域或將迎來快速發展大潮。
比如,通過《醫療器械注冊與備案管理辦法》(市場總局令第47號)、《體外診斷試劑注冊與備案管理辦法》(市場總局令第48號)這2部規章的頒發,我國醫療器械注冊管理法規體系框架得到進一步完善。《醫療器械注冊與備案管理辦法辦法》落實了注冊人、備案人制度,對審評審批工作程序進行了優化,增加了臨床試驗監管內容等,為企業提供了更合理、更高效的政策支持。
創新產品注冊、優先注冊、應急注冊等特殊注冊程序被寫進《辦法》,將從制度層面進一步促進行業創新,市場創新活力將被釋放,以更好地滿足人民群眾對高質量醫療器械的期待。
據國藥監局,2021年截至12月16日,國內共有34個創新器械獲批,單年數量創新高,2019—2020年的獲批創新器械分別為19個、26個,開啟了中國醫療器械創新元年。
為向醫療器械企業提供便利,促進國產醫療器械行業穩步快速發展,國藥監局先后發布醫療器械和體外診斷試劑臨床試驗、臨床評價等9個指導原則。為規范各級藥品監管部門注冊審批工作,國藥監局又發布境內第二類、第三類和進口醫療器械注冊審批操作規范。
《醫療器械應急審批程序》的發布,總結了新冠疫情防控經驗,完善了醫療器械應急審批要求;《體外診斷試劑分類規則》的發布,主要為體外診斷分類提供指導;《醫療器械注冊自檢管理規定》則明確了醫療器械注冊自檢工作的管理要求。
最備受矚目的《醫療器械監督管理條例》(2021版)(以下簡稱“《新條例》”》在2021年3月19日正式頒布,自2021年6月1日起施行。《條例》自2000年4月1日生效并實施,于2014年進行了第一次重大修訂。
本次《新條例》修訂,最重要的內容是設立醫療器械注冊人制度,明確定義了醫療器械注冊人、備案人的概念,并明確指出了注冊人、備案人的相關義務。此前,醫療器械注冊證和生產許可證必須是同一主體(創新醫療器械除外),醫療器械注冊人制度的提出,將注冊證和生產許可證解綁,有利于優化資源配置,促進產業集中,提升市場競爭力。
從并購的角度出發,企業可將擬轉讓的醫療器械注冊證打包并入標的公司,從而方便收購放集中收購,將帶動醫療器械行業的投資發展。
值得注意的是,《新條例》對醫療器械的生產、經營、使用等方面都作出詳細規定,監管力度以及處罰程度均達到空前力度。
以處罰為例,注冊人對產品全生命周期的質量須承擔法律責任,每個醫療器械將有唯一標識以供溯源管理。對于涉及質量安全的違法行為,最高可處以貨值金額30倍的罰款;視違法情節對違法者處以吊銷許可證件、一定期限內禁止從事相關活動、不受理相關許可申請等處罰;對嚴重違法單位的相關責任人員處以沒收收入、罰款、5年直至終身禁止其從事相關活動等處罰。
此外,《“十四五”醫療裝備產業發展規劃》的發布,提出了2025年醫療裝備產業發展的總體目標和2035年的遠景目標,并提出保證目標實現的推進思路,將對該行業全產業鏈產生深遠影響。
診斷檢驗裝備、治療裝備、保健康復裝備、有源植介入器械等重點領域的提出,基本覆蓋了全人群從防、診、治到康、護、養全方位醫療健康服務裝備需求。屆時,隨著目標的逐步實現,國產器械行業集中度有望進一步提升,龍頭企業在技術水平、產業鏈安全、跨界融合能力、國際化能力等方面都將得到強化。
(全文14251字)
參考資料
《年度企業數據|2021年全國醫療器械經營企業數量突破90萬家》.眾成醫械
《2021中國醫療器械一級市場融資回顧》.眾成醫械
《關注函已成家常便飯?九安醫療兩個月內第25次漲停》.上海證券報
《正川股份2019—2020年年度報告》.公司公告
《正川股份實控人被指操縱股價,律師稱如違法屬實投資者可索賠》.投研電訊
《史上最嚴醫療器械行業監管條例1日起實施》.新華社
來源:生活資訊網

評論前必須登錄!
立即登錄 注冊